我校生命科学学院李根喜教授团队近期在《Nucleic Acids Research》杂志上发表了题为“Hydrazone chemistry-mediated CRISPR/Cas12a system for bacterial analysis”(Nucleic Acids Research, gkac809, https://doi.org/10.1093/nar/gkac809)的原创性研究论文。

该研究工作通过采用腙化学和巧妙的核酸序列设计,利用互补碱基配对引起的邻近效应加速整个激活链的形成,从而快速有效地激活CRISPR/Cas12a系统,并进而提出了一种简单而灵敏的铜绿假单胞菌分析方法。
Cas12a是一种来自V-A型CRISPR系统的核酸内切酶,通过识别其靶位点,激活内源性核酸酶活性后,可以不加区分地切割单链DNA(ssDNA),已被用于核酸检测。然而,该系统不适合区分非常相似的单链DNA序列;并且,相似单链DNA序列之间的干扰可能会发生交叉反应,影响分析的灵敏度和特异性。由于CRISPR/Cas系统的可编程性依赖于导链RNA和核酸的相互作用,研究团队设想可以在系统的启动序列中引入腙化学,从而更灵活地激活CRISPR/Cas12a系统,不仅可以提高特异性,而且可以广泛应用于不同靶标的分析。
为了将腙化学应用于CRISPR/Cas12a系统中,研究团队巧妙地将激活链设计为发夹结构的两个片段,并分别由酰肼和醛基两个腙连接基团修饰。在碱基互补配对的作用下,含有酰肼基团的TS1更容易与修饰醛基基团的TS2链通过腙键反应形成完整的TS1/TS2链。激活的Cas12a/crRNA复合体的反式裂解活性导致ssDNA-FAM的任意切割和荧光恢复(图1)。腙化学的引入可以提高CRISPR/Cas12a系统的特异性,可以有效区分目标序列中的单碱基错配。
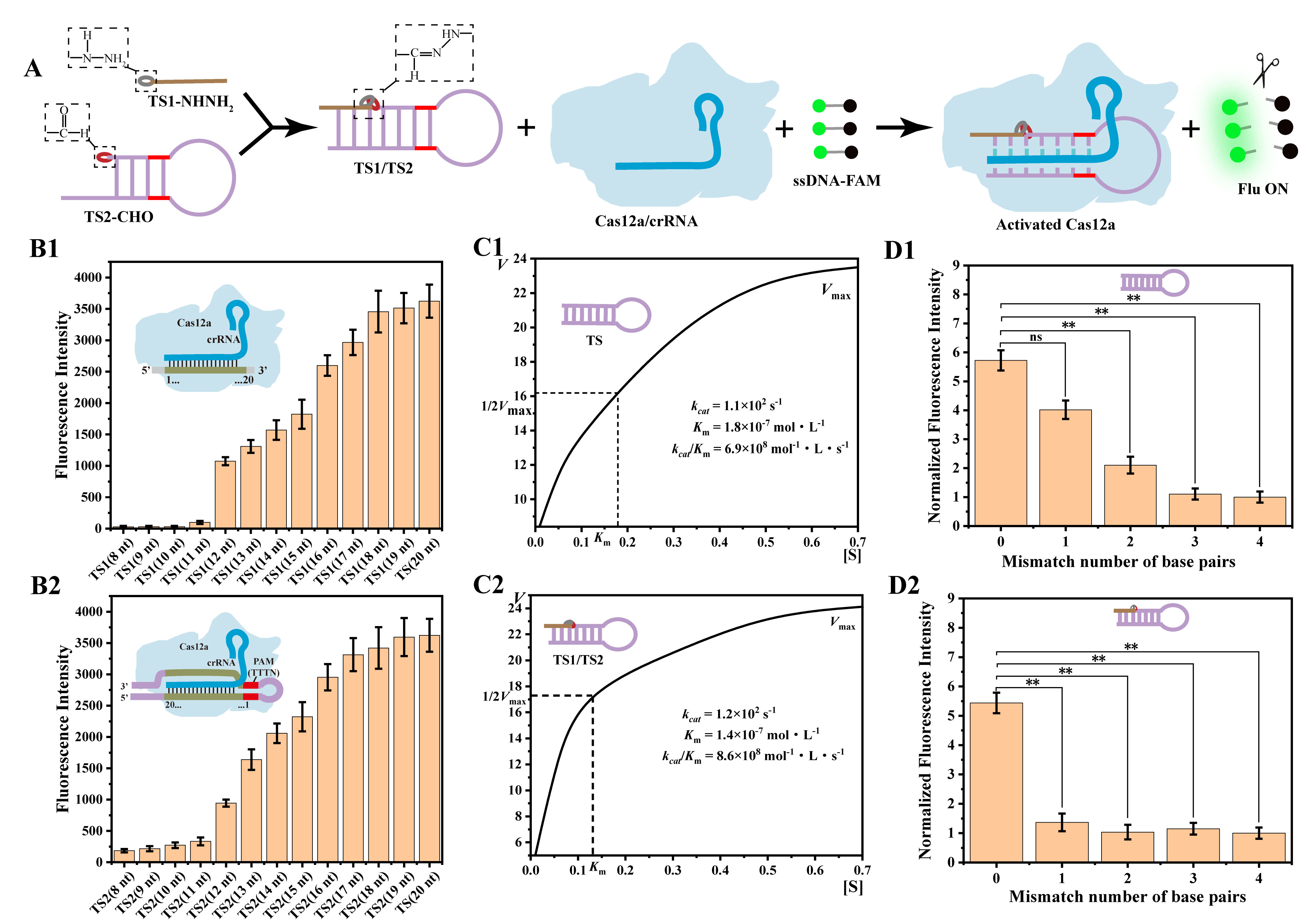
图1 腙化学介导的CRISPR/Cas12a系统
研究团队将所构建的腙化学介导CRISPR/Cas12a系统进一步用于细菌分析,他们选取了具有物种间高度保守的区域和物种特异性的可变区域16S rRNA基因序列(16S rDNA)作为靶标,该序列也通常被用于各种细菌的鉴定。研究团队精心设计16S rDNA探针互补序列,由于16S rDNA与探针的特异性结合,从而释放Probe/TS1-NHNH2杂交链中的TS1-NHNH2,该链可以通过碱基互补配对与TS2-CHO杂交,其中TS1-NHNH2修饰的酰肼基与TS2-CHO修饰的醛基之间的腙键加速TS1/TS2的形成,而形成的TS1/TS2可以激活CRISPR/Cas12a系统,对ssDNA-FAM进行切割,导致荧光的恢复(图2)。
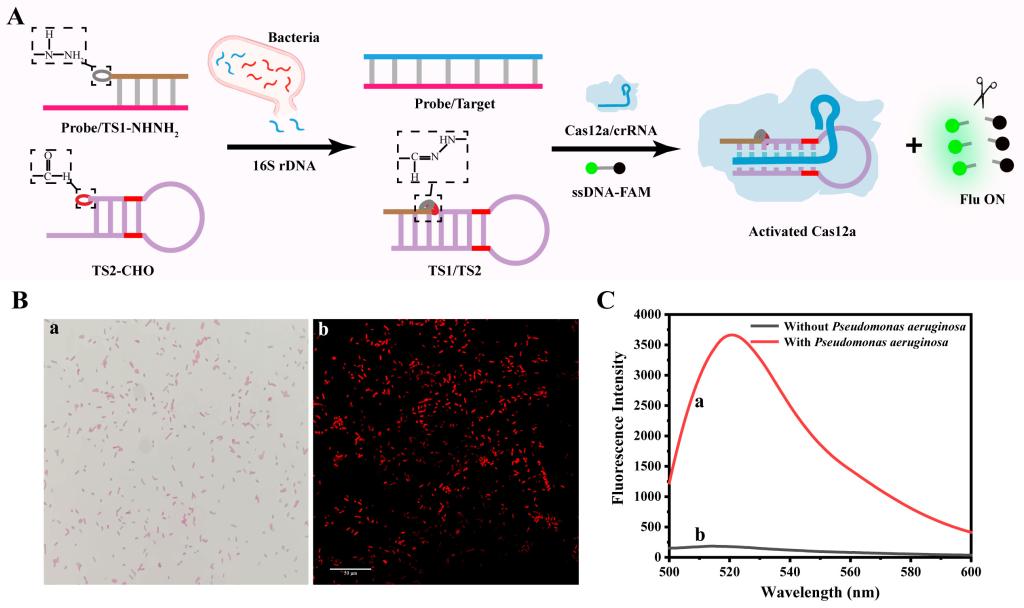
图2 基于腙化学介导的CRISPR/Cas12a系统的细菌分析机理
综上所述,研究团队构建了一个腙化学介导的CRISPR/Cas12a系统,并探索了其识别单碱基错配的能力。在这一设计中,他们利用碱基互补配对产生的邻近效应加速了腙键的形成。同时,由于其模块化和独特的结构性质,腙化学可以将分裂的激活链连接到整个激活链上,从而有效地激活CRISPR/Cas12a系统。在此基础上,他们进一步开发了高灵敏度的细菌检测平台,并应用于细菌检测。该平台操作简单,灵敏度高,检出限低,特异性好,不仅可以应用于细菌中16S rDNA的检测,而且可以借助适体或探针识别级联反应直接检测核酸靶点。同时,该平台还可以为其他非核酸靶标的间接检测提供了稳定、经济的检测系统。因此,腙化学的引入拓宽了CRISPR/Cas12a系统的应用范围。
上海大学为本文第一署名单位,博士研究生生安志同学为论文第一作者,李根喜教授和张娟教授为共同通讯作者。研究工作得到了国家自然科学基金以及上海市“浦江学者”专项计划项目的资助。