随着生物体年龄增加,机体的氧化和抗氧化作用失衡,由此产生的过量自由基会造成体内多种功能性生物大分子的氧化损伤,从而引起细胞与组织衰老。过多的衰老细胞会产生大量的衰老相关分泌表型(SASPs),作用于周边的细胞,进而产生更多衰老细胞,同时也易促进异常细胞(如癌细胞)的产生和增长。因此,衰老被认为是许多慢性疾病的风险因素之一,而延缓衰老则可为降低缺血性心脏病、阿尔兹海默症、中风、慢性阻塞性肺病等衰老相关性疾病(aging-related disease)的发病率提供一种有效医疗途径。降低可引发衰老的细胞氧化应激水平提供潜在抗衰老策略。

2023年1月,上海大学赵春华教授团队发表题为Ultra-small polydopamine nanomedicine-enabled antioxidation againstsenescene的研究论文。该研究开发了具有逆转氧化应激诱导衰老的超小聚多巴胺纳米颗粒UPDA NPs,并通过多种细胞与生物模型在细胞与分子生物学水平上揭示了UPDA NPs的抗衰老机制。
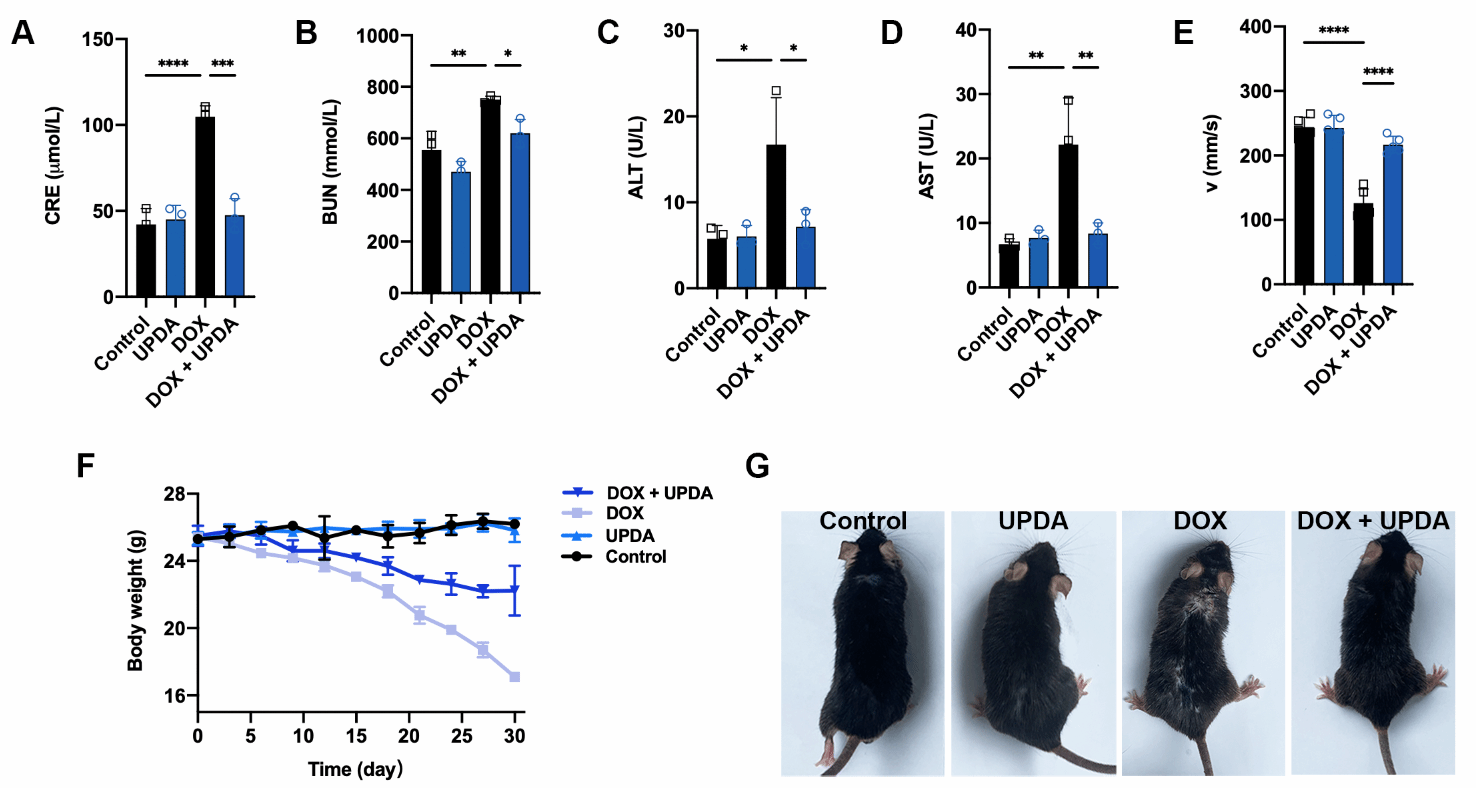
首先通过液相剥离技术合成了UPDA NPs。发现该纳米颗粒具有过氧化氢酶和过氧化物歧化酶的酶活性,可以有效清除多种活性氧自由基和活性氮自由基。并通过一系列体外体内实验证明UPDA NPs具有保护细胞抵抗DOX、H2O2、D-gal诱导的氧化应激的能力,可以恢复小鼠衰老相关的肾功能、组织稳态、毛发密度和运动能力。
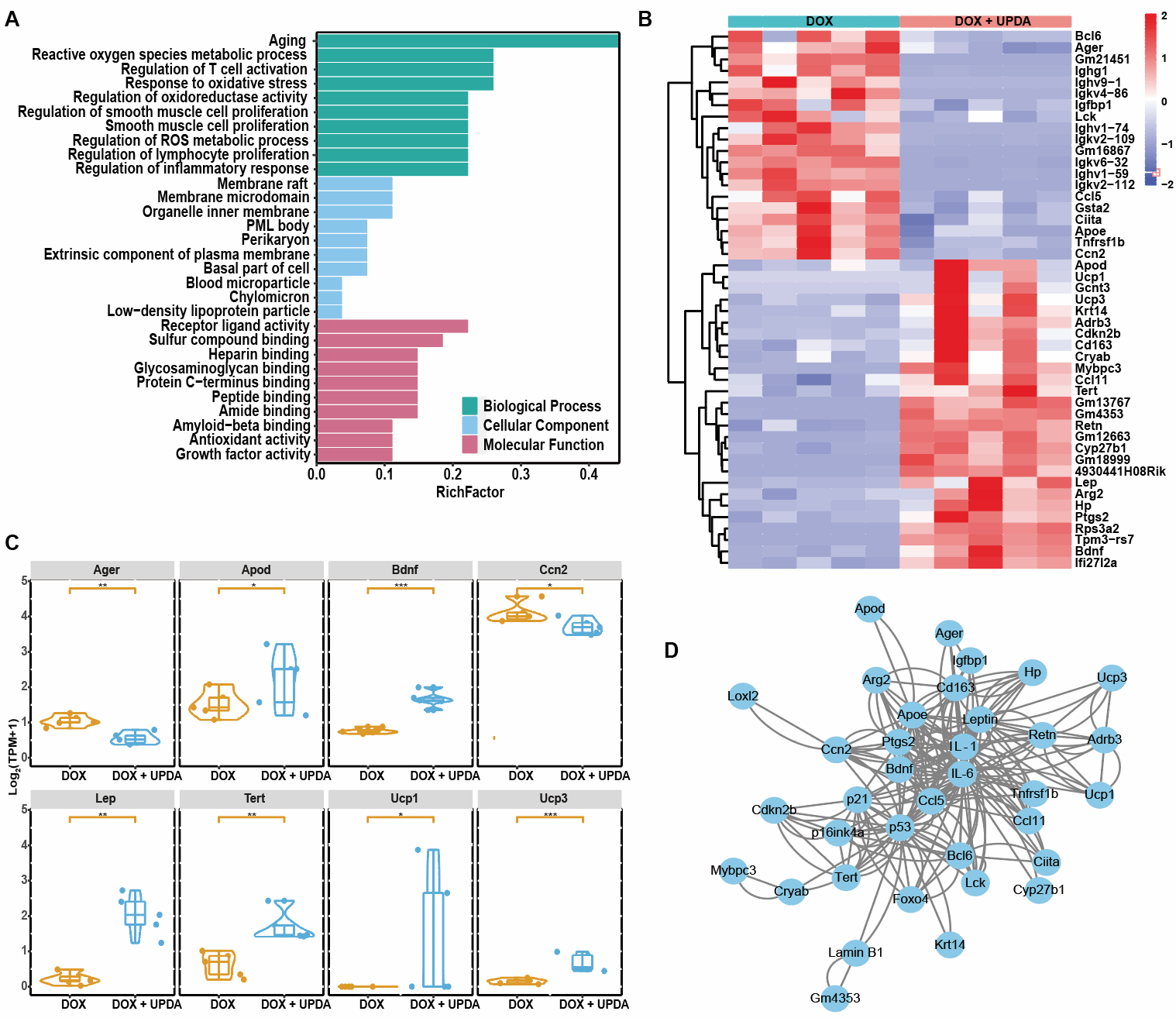
深入探究了UPDA NPs抗氧化应激的调控机制。通过转录组学测序发现在上调的差异基因中,载脂蛋白D (ApoD)能抑制脂质过氧化,对抗大脑中的氧化应激。解偶联蛋白1(Ucp1)是棕色脂肪组织的生物标志物,在衰老过程中表达和活性降低,Ucp1的上调可以抑制炎症小体NLRP3的激活,并保护动物免受冠状动脉粥样硬化的影响。解偶联蛋白3(Ucp3)上调可以抑制线粒体当中ROS的生成,保护氧化应激诱导的器官损伤;端粒酶逆转录酶(Tert)作为一种细胞衰老抑制剂表达上调。瘦素(Lep)是一种维持能量稳态的激素,可以保护超氧化物诱导的氧化应激损伤。在UPDA NPs存在时,瘦素表达增加。脑源性神经营养因子(Bdnf)上调能够维持神经元培养中的氧化还原稳态,而且可以通过抑制NF-κB信号通路抑制衰老小胶质细胞激活。观察NF-κB信号通路,SASPs的主要调控因子、也被确定为UPDA NPs调节的差异基因的丰富通路之一。相应地,在下调的差异基因中,Arger是糖基化晚期终末产物的特异性受体,通过激活NF-κB通路诱发炎症。而细胞通信网络因子2(Ccn2)通过与受体激活因子作用来激活NF-κB通路。总之,研究证明UPDA NPs抵抗氧化应激诱导的衰老与脂质代谢、线粒体功能、能量稳态、端粒酶活性、神经保护和炎症反应相关的多种调节基因有关。
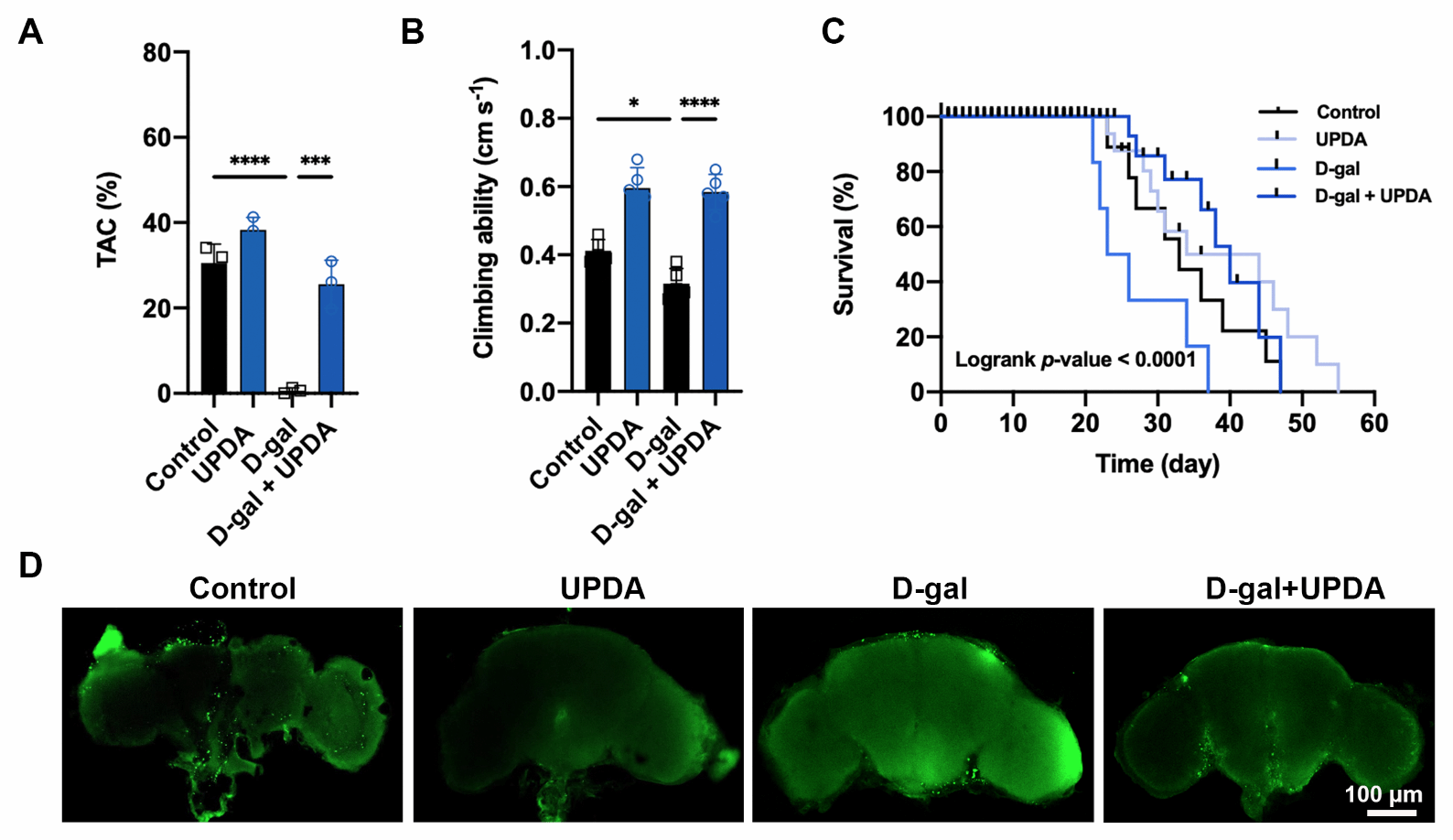
研究人员还测试了另外一种动物模型,通过对果蝇饮食调节发现UPDA NPs可以提高衰老果蝇的抗氧化能力,增强攀爬能力,延长寿命,这可能与防止大脑凋亡有关。由于细胞凋亡本身可由多种因素诱导,如细胞周期抑制剂p16ink4a和促炎细胞因子IL-1β,所以UPDA NPs的抗衰老作用来自不同的抗衰老机制的组合。
综上所述,该研究设计并合成了一种均匀、稳定、安全、具有抗衰老潜力的有机聚合物纳米酶UPDA NPs,揭示了其在药物诱导的衰老细胞和模型生物中的细胞保护和抗衰老作用,且具有易修饰,易代谢,易降解的优势,对于利用纳米材料进行抗衰老及相关疾病治疗的临床转化研究具有重要指导意义。
上海大学韩佳媚博士为本文第一作者,赵春华教授为本文通讯作者,陈雨教授、冯炜研究员、美国University of North Dakota的Holly M. Brown-Borg为共同通讯作者,文章发表在Materials Today Bio(杂志影响因子:10.76)期刊上。
原文链接:https://doi.org/10.1016/j.mtbio.2023.100544