病原微生物感染中枢神经系统(Central nervous system,CNS)可引发脑炎及脑部炎症性病变。在病毒感染脑部过程中,CNS定居的小胶质细胞和浸润的巨噬细胞能分泌多种炎症因子参与病毒的清除,但过量的炎症因子尤其TNF-α会诱导神经元凋亡进而作为危险信号进一步加重巨噬细胞活化,导致严重的CNS炎症反应。哪些关键分子能调控神经元和巨噬细胞的相互作用是决定病毒性脑炎发展程度的关键因素。

上海大学生命学院魏滨教授(曾任中科院武汉病毒所研究员)团队与中国科学院分子细胞科学卓越创新中心(即上海生化与细胞所)王红艳研究员团队合作在CellReports杂志上发表了题为VEGFR-3 signaling restrains the neuron-macrophage crosstalk during neurotropic viral infection的文章。研究发现病毒感染中枢神经系统时,上调表达的血管内皮生长因子-C(VEGF-C)及受体VEGFR-3能调控巨噬细胞和神经元间的相互作用,减少神经元的凋亡,减轻病毒性脑炎的程度。
研究团队前期发现细菌感染的巨噬细胞也能升高表达VEGFR-3受体,并分泌VEGF-C。病毒感染激活的VEGFR-3信号负反馈抑制TLR4-NF-κB诱导的过度炎症,从而减少细菌感染诱发的败血症休克(Immunity,2014. 40(4):501-514)。同时,该团队近期的研究也发现VEGF-C/VEGFR-3信号可以增强脑膜淋巴管的增生,并且脑膜淋巴管能将病毒从中枢神经系统运输到外周淋巴结,最终改善嗜神经病毒感染引起的脑部损伤(Nature Neuroscience, 2022. 25(5):577-587)。但是尚不清楚VEGFR-3和VEGF-C如何调控巨噬细胞和神经元的cross-talk。
在本研究中,研究人员构建不同嗜神经病毒(JEV、ZIKV和HSV-1)感染的小鼠模型,发现在病毒感染的脑组织中VEGFR-3和配体VEGF-C的含量显著上调。利用巨噬细胞和神经元共培养体系或使用病毒感染的神经元的细胞上清处理巨噬细胞等策略,发现病毒感染的脑组织中升高的VEGF-C能结合并激活巨噬细胞中VEGFR-3信号通路,通过调控PI3K-AKT和MAPK的活化以抑制TNF-α分泌,减少神经元凋亡。为阻断过度的TNF-α加重病毒性脑炎的作用,研究人员使用临床药物依那西普(即重组肿瘤坏死因子受体)处理JEV感染的小鼠以阻断TNF-α与TNF受体的结合。发现通过依那西普阻断TNF-α可减少脑部炎症程度,降低神经元的凋亡以保护宿主。
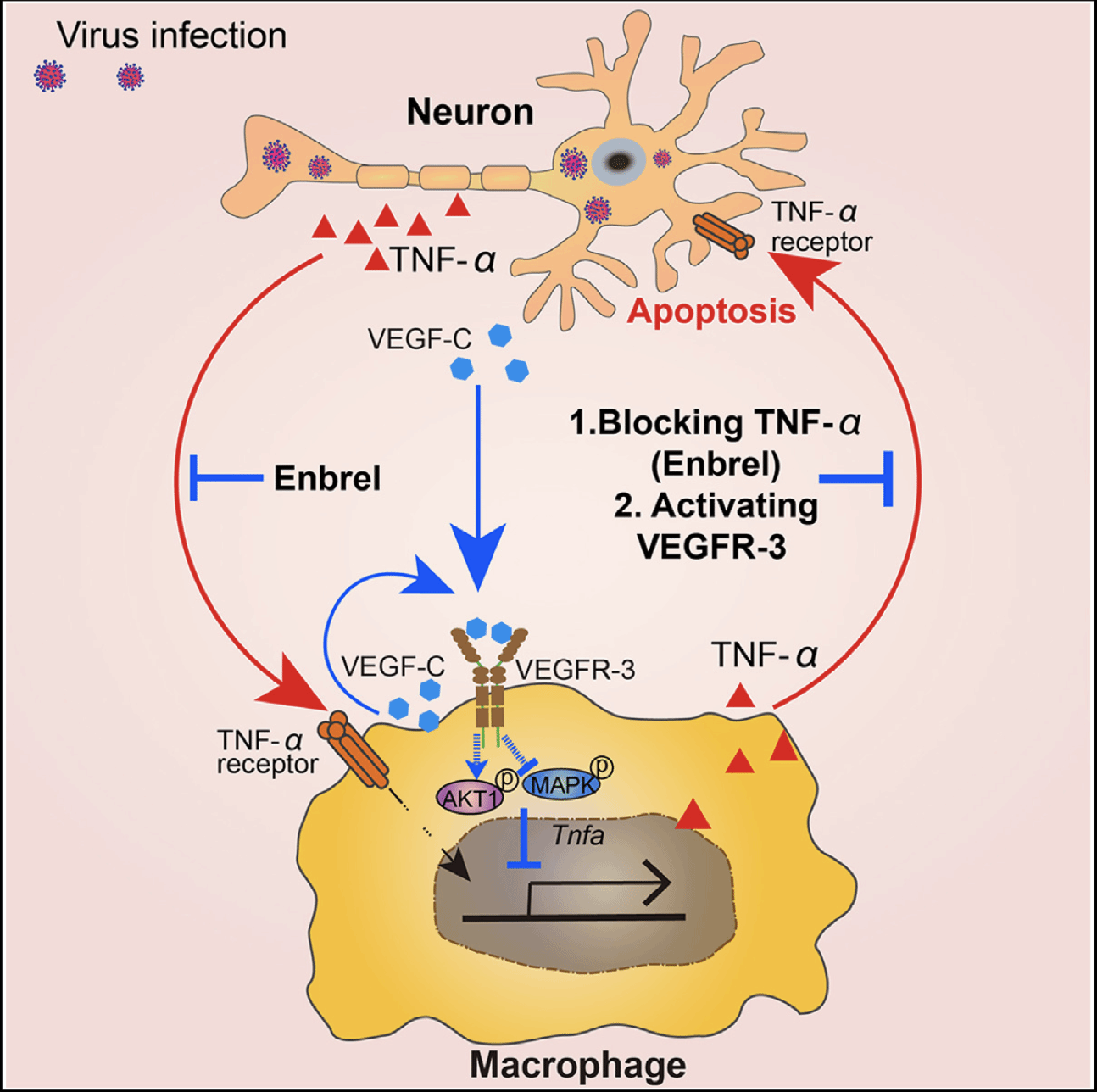
综上图所述,这项研究揭示病毒感染CNS时,多种细胞包括神经细胞能分泌产生细胞因子VEGF-C,通过结合并激活巨噬细胞表面受体VEGFR-3,抑制TNF-α分泌以破坏神经元与巨噬细胞之间的炎症放大的环路,最终发挥宿主自我调控(self-control)的保护机制,降低嗜神经病毒感染的危害。
上海大学医学院博士后齐琳琳、博士生李小静和同济大学附属第十人民医院张芳博士为本文的共同第一作者。上海大学是第一作者单位。该项目得到国家自然科学基金重点项目,科技部国家重点研究计划重点专项、上海市优秀学术带头人计划的资助。